Defects in Solids. Why Do Defects Form?. Some Thermodynamics Ideas. Point Defects. The Statistics of Point Defects. Line Defects—Dislocations. Edge Dislocations. Screw Dislocations. Burger’s Vector and the Burger Circuit. Dislocation Motion. Planar Defects. Grain Boundaries. Twin Boundaries. Three-Dimensional Defects
domingo, 30 de mayo de 2010
sábado, 29 de mayo de 2010
Defects in Solids: Dislocaciones Mixtas
martes 25 de mayo de 2010
Dislocaciones Mixtas
DISLOCACIONES MIXTAS
Con frecuencia los cristales exhiben mezcla de las dislocaciones anteriores. Su vector de Burgers no es ni perpendicular ni paralelo a la línea de dislocación, pero mantiene una orientación fija en el espacio. La estructura atómica local en torno a la dislocación mixta es difícil de visualizar, pero el vector de Burgers proporciona una descripción conveniente y sencilla.
Con frecuencia los cristales exhiben mezcla de las dislocaciones anteriores. Su vector de Burgers no es ni perpendicular ni paralelo a la línea de dislocación, pero mantiene una orientación fija en el espacio. La estructura atómica local en torno a la dislocación mixta es difícil de visualizar, pero el vector de Burgers proporciona una descripción conveniente y sencilla.

SIGNIFICADO DE LAS DISLOCACIONES
Aunque los deslizamientos o desplazamientos atómicos pueden ocurrir en cerámicos y polímeros, estos procesos son particularmente útiles para entender el comportamiento mecánico de los metales. Primero que todo, el deslizamiento atómico explica porque la resistencia de los metales es mucho mas baja que el valor teórico predicho de los enlaces metálicos. Cuando los deslizamientos ocurren, solo una pequeña fracción de todos los enlaces metálicos a lo largo de la inter-fase necesita ser roto y la fuerza requerida para deformar el metal es pequeña. Segundo, los deslizamientos proveen ductilidad en los metales. Si no estuvieran presentes las dislocaciones, una barra de hierro sería frágil y los metales no podrían ser moldeados por varios procesos tales como forjado. Tercero, es posible controlar las propiedades mecánicas de un metal o aleación interfiriendo con el movimiento de las dislocaciones. Un obstáculo introducido dentro del cristal evita que una dislocación se deslice a menos de que se aplique una fuerza muy grande.
Es posible encontrar un gran número de dislocaciones en los materiales. La densidad de las dislocaciones o longitud total de las dislocaciones por unidad de volumen, se usa generalmente para representar la cantidad de dislocaciones presentes. Densidades de dislocaciones de 10 m. mm-3 son típicas de los metales más suaves, mientras que densidades de dislocaciones superiores a 1000 Km. mm-3 se pueden conseguir deformando el material.
LEY DE SCHMID
Se puede entender las diferencias en el comportamiento de los metales que tienen diferentes estructuras, examinando la fuerza requerida para iniciar el proceso de deslizamiento.
Suponga que se aplica una fuerza unidireccional F a un cilindro de metal que es un cristal simple o mono-cristal. Es posible ubicar el plano de deslizamiento y la dirección de desplazamiento al aplicar la fuerza, defieniendo los ángulos.
Se puede entender las diferencias en el comportamiento de los metales que tienen diferentes estructuras, examinando la fuerza requerida para iniciar el proceso de deslizamiento.
Suponga que se aplica una fuerza unidireccional F a un cilindro de metal que es un cristal simple o mono-cristal. Es posible ubicar el plano de deslizamiento y la dirección de desplazamiento al aplicar la fuerza, defieniendo los ángulos.

Para que la dislocación se mueva en el sistema de deslizamiento, se necesita que actúe una fuerza cizalladura en dirección del desplazamiento, producida por la fuerza aplicada.

Etiquetas:
2010 Michelangeli Gayon
Defects in Solids: Dislocaciones
Defectos de linea (Dislocaciones)...
DISLOCACIONES
Son defectos que dan lugar a una distorsión de la red centrada en torno a una línea. Se crean durante la solidificación de los sólidos cristalinos o por deformación plástica, por condensación de vacantes.
Hay dos tipos de dislocaciones, las de cuña y las helicoidales. También puede darse una combinación de ambas, denominada dislocación mezcla
Son defectos que dan lugar a una distorsión de la red centrada en torno a una línea. Se crean durante la solidificación de los sólidos cristalinos o por deformación plástica, por condensación de vacantes.
Hay dos tipos de dislocaciones, las de cuña y las helicoidales. También puede darse una combinación de ambas, denominada dislocación mezcla
-
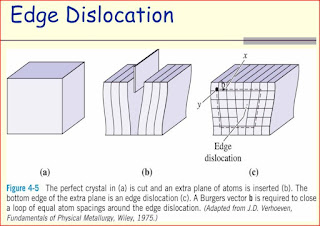
Dislocación de Cuña: Se crea por inserción de un semiplano adicional de átomos dentro de la red. Los átomos a lado y lado del semiplano insertado se encuentran distorsionados. Los átomos por encima de la línea de dislocación, que se encuentra perpendicular al plano de la página, en el punto donde termina el semiplano insertado, se encuentran comprimidos y los que están por debajo se encuentran apartados. Esto se refleja en la leve curvatura de los planos verticales de los átomos más cercanos del extra semiplano. La magnitud de esta distorsión decrece con la distancia al semiplano insertado. La distancia de desplazamiento de los átomos en torno a una dislocación se llama DESLIZAMIENTO o vector de Burgers y es perpendicular a la línea de dislocación de cuña.
-
DISLOCACIÓN HELICOIDAL: Esta dislocación se forma cuando se aplica un esfuerzo de cizalladura en un cristal perfecto que ha sido separado por un plano cortante. Aquí el vector de Burgers o de desplazamiento es paralelo a la línea de dislocación.


Etiquetas:
2010 Michelangeli Gayon
Defects in Solids: Otros Defectos Puntuales Importantes
Otros Defectos Puntuales Importantes
DEFECTO FRENKEL
Es una imperfección combinada Vacancia – Defecto intersticial. Ocurre cuando unión salta de un punto normal dentro de la red a un sitio intersticial dejando entonces una vacancia.
Es una imperfección combinada Vacancia – Defecto intersticial. Ocurre cuando unión salta de un punto normal dentro de la red a un sitio intersticial dejando entonces una vacancia.

DEFECTO SCHOTTKY
Es un par de vacancias en un material con enlaces iónicos. Para mantener la neutralidad, deben perderse de la red tanto un catión como un anión.
Otro defecto puntual importante ocurre cuando un ion de una carga reemplaza otro ion de diferente carga. Por ejemplo un ion de valencia +2 reemplaza a un ion de valencia +1. En este caso una carga extre positiva se introduce dentro de la estructura. Para mantener un balance de carga, se debe crear una vacante de una carga positiva (Enlaces iónicos).
Etiquetas:
2010 Michelangeli Gayon
Defects in Solids: Defectos Puntuales
Defectos Puntuales
DEFECTOS INSTERSTICIALES, ocurre cuando un átomo extra se inserta dentro de la estructura de la red en una posicón que normalmente no está ocupada. Generalmente en este tipo de defecto introduce relativamente grandes distorsiones en los alrededores puesto que el átomo es sutancialmente mas grande que la posición intersticial en la que se sitúa. Consecuentemente la formacion de este defecto no es muy probable. Se pueden introducir en una estructura por radiación.

IMPUREZAS EN SOLIDOS, este defecto se introduce cuando un átomo es reemplazado por un átomo diferente. El átomo sustituyente puede ser más grande que el átomo original y en ese caso los átomos alrededor están a compresión ó puede ser más pequeño que el átomo original y en este caso los átomos circundantes estarán a tensión. Este defecto puede presentarse como una impureza o como una adición deliberada en una aleación.

Dependiendo de la clase de impureza que se halle en el cristal, de su concentración y de la temperatura se formará en el cristal una SOLUCIÓN SÓLIDA. Cuando se habla de solución sólida hay que hacer claridad sobre algunos términos:
-
Soluto: Es el elemento o compuesto dentro de la solución sólida, que se encuentra en menor concentración.
-
Solvente: Es el elemento dentro de la solución sólida, que se encuentra en mayor concentración.
Una solución sólida se forma cuando átomos de soluto se adicionan al material y la estructura cristalina original se mantiene. Se puede asimilar a una solución líquida en la que también los átomos que constituyen las impurezas (soluto) están distribuidos al azar y uniformemente dispersos dentro del sólido.
Los defectos puntuales de impurezas dentro de las soluciones sólidas pueden generarse por dos mecanismos:
Los defectos puntuales de impurezas dentro de las soluciones sólidas pueden generarse por dos mecanismos:
-
Sustitución: Aqui el soluto y las impurezas reemplazan a átomos originales. Esto se da cuando los átomos que constituyen el soluto y el solvente cumplen con los siguientes requerimientos(Reglas de Hume-Rothery):
-Los radios atómicos no difieren más del 15%.
-Las estructuras cristalinas deben ser las mismas.
-Las electronegatividades deben ser similares ya que de otra manera reaccionarían y se formarían nuevos compuestos.
-Deben tener la misma valencia.


Etiquetas:
2010 Michelangeli Gayon
Defectos Estequiometricos BLOG 10
sábado 29 de mayo de 2010
Defectos Estequiometricos
Defectos estequiométricos
Los compuestos estequiométricos son aquellos que contienen siempre los mismos elementos en la misma proporción en peso. Se les denomina también 'daltónidos' (de Dalton), en contraste con los no estequiométricos o 'bertólidos' (de Berthollet). Se observan en los compuestos estequiométricos dos tipos de defectos: Schottky y Frenkel. En el cero absoluto estos cristales iónicos estan perfectamente ordenado pero a medida que aumenta la temperatura algunos iones abandonan sus posiciones correctas creando un defecto.
Defectos Schottky Un ion positivo y otro negativo están ausentes de la red, no alterando ni la neutralidad ni lacomposición. Se producen dos agujeros o huecos en los que no existen átomos, a la vez que se mantiene la estequiometría. Ocurre en los compuestos iónicos cuyo cation y anión son de tamaño similar y número de coordinación 6 u 8, como en NaCl, KCl. CsCl, KBr.
El número de estos defectos por cm2 (NS), está relacionado con el trabajo necesario para crear ese defecto (DHS) y con la temperatura mediante la expresión:
NS = N·exp[-DHS/2kT]. k es la constante de Boltzman
N es el número de cationes y aniones por unidad de volúmen.

Defectos Frenkel
Es una vacante en un sitio donde debería estar situado un ion. Este ion pasa a una posición
intersticial. Los cationes suelen ser más pequeños que los aniones por lo que son estos los que
suelen faltar de sus posiciones correctas. Se dan en compuestos con gran diferencia de tamaños
del anión y catión: AgX (X, haluro), ZnS. El número de estos defectos por unidad de volumen
es:
NF = (NN')1/2 exp[-DHF/2kT],
donde N y N' es el número de átomos y de posiciones intersticiales por unidad de volumen.
El que en un cristal se presenten un tipo u otro de defectos depende de la entalpía de formación
de estos defectos. En algunos cristales pueden presentarse ambos tipos.
Como consecuencia de estos defectos los compuestos iónicos pueden presentar algún grado
de conductividad eléctrica. Si un ion se mueve a un nuevo agujero deja un agujero. El proceso se
70
puede repetir con lo que se produce una migración de cargas o conducción. Este tipo de
semiconducción es la responsable del ruido de fondo producido por los transistores.

MOISES PINEDA
CI 18694836
CAF
Etiquetas:
2010 CAF MOISES PINEDA
Suscribirse a:
Entradas (Atom)



























